Multiresistente bakterier er en global sundhedstrussel. RUC-forskere arbejder på at finde en løsning ved at erstatte antibiotika med såkaldte AMP’er.
Har du prøvet at få infektion i et sår eller døjet med betændelse? Så er du formentlig blevet behandlet med antibiotika. Men antibiotika er ved at miste sin virkning på nogle bakterier. Faktisk ser man, at alle de mest almindelige bakterier, der medfører sygdom hos mennesker, samlet set er blevet mindre følsomme over for antibiotika. Ifølge FN kan der i 2050 være op til 10 millioner mennesker, der årligt dør af bakterieinfektioner, som er resistente over for medicin. Hvad kan vi gøre for at forhindre det?
Det spørgsmål arbejder jeg med i min forskningsgruppe på Roskilde Universitet. Og i denne artikel vil jeg forklare, hvordan vi forsøger at bidrage til at løse problemet.
Penicillins fantastiske virkning
Den medicinske revolution startede for alvor med Sir Alexander Flemings opdagelse af penicillin, som siden er blevet brugt til behandling af bakterielle infektioner.
Penicillin virker ved at hæmme krydsbundne polymerkæder af sukker med små peptidkæder, der ellers vil danne et solidt lag, der omslutter bakteriecellen.
Laget af peptidoglykan beskytter bakteriens cellemembran med et dobbelt lag af fedtsyrer mod ydre miljøpåvirkninger. Polymerlaget findes i alle bakterier, men ikke i vores celler, hvilket betyder, at penicillin er en specifik gift, der kun hæmmer vækst af bakterier.
Introduktion af penicillin har derfor haft en eventyrlig betydning for folks helbred, vores evne til at udføre komplekse operationer og behandle kræft ved immunterapi.
Sådan udvikler bakterier resistens
Kort efter introduktionen af penicillin blev der også opdaget en række nye antibiotika fra andre kilder. Enkelte forskere mente naivt nok, at kampen mod patogene bakterier – det vil sige bakterier, der kan føre til sygdom – var vundet.
Alexander Fleming havde dog allerede advaret om, at til trods for penicillins evne til specifikt at hæmme bakterievækst så var der også bakterier, der over tid ville tilegne sig evnen til at modstå penicillins effekt.
Det skyldes evolution, som er et resultat af tilfældige genetiske ændringer (mutationer), der opstår, når en celle deler sig. Da bakterier reproducerer sig op til to gange i timen, vil effekten af disse mutationer kunne observeres relativt hurtigt.
Nogle mutationer vil føre til, at bakterien dør, mens andre mutationer vil give den et genetisk fortrin. Når bakteriecellen vokser og deler sig, skal der laves store mængder af det beskyttende peptidoglykan-lag.
Der er et specifikt molekyle i bakterien, en slags brobygger, der hjælper til med at krydsbinde polymerkæderne. Denne brobygger kan også binde penicillin, og på den måde klarer den ikke længere at udføre sit normale arbejde. Dermed bliver peptidoglykan-laget ikke dannet, og bakterien dør.
Spontane mutationer kan ændre strukturen på brobygger-molekylet, så det ikke længere kan binde penicillin, og dermed vil bakterien overleve. Bakterien har udviklet resistens.
Problemet med multiresistens
I tillæg til denne type resistens kan resistens-gener eller grupper af gener flyttes mellem bakterier. På den måde kan man få dannet bakterier, der er resistente mod en række antibiotika. Det er de såkaldte multiresistente bakterier, eller superbakterier.
Kort sagt vil brug af antibiotika føre til udvikling af resistens. Hvis man fjerner brugen af et specifikt antibiotikum, vil resistensen derfor gå tabt over tid.
Dog er det med antibiotikaresistens som med renten: Den hæves hurtigt, men justeres meget langsomt ned igen. Men det er ikke kun brug af store mængder antibiotika, som er problematisk.
Generelt anses forkert brug af antibiotika som den største udfordring og faktor, der driver udviklingen af resistens.
Til trods for at vi er relativt dygtige til at bruge små mængder antibiotika og følge lægens anbefalinger om dosering og tid i Nordeuropa, henter vi årligt nye eksotiske multiresistente bakterier med hjem til Danmark fra vores dejlige ferier i udlandet.
Derfor er bredspektret antibiotikaresistens et voksende problem i samfundet.
Nye antibiotika af AMP’er
Det er derfor yderst vigtigt at opretholde et fokus på at fremskaffe nye antibiotika til fremtiden. I den forbindelse er antimikrobielle peptider (AMP’er) blevet udpeget som et muligt håb.
AMP’er er en urgammel gruppe af molekyler, der er blevet identificeret i alle former for liv. Præcis det fortæller os, at de er nedarvet og udviklet gennem millioner af år. Og det underbygger deres væsentlige rolle i vores eksistens.
Hos mennesker udskilles AMP’er af forskellige immunceller. De er derfor en naturlig del af den kemiske sammensætning af vores kropsvæsker, som spyt, urin, tårevæske, sved og brystmælk.
AMP’er udgør et primitivt forsvarsværk mod indtrængende mikroorganismer såsom bakterier, svampe og vira. Derudover vil immuncellerne være i stand til at genkende patogene mikroorganismer, der potentielt kan gøre os syge, og som svar på dette vil immuncellerne udskille større mængder af AMP’er.
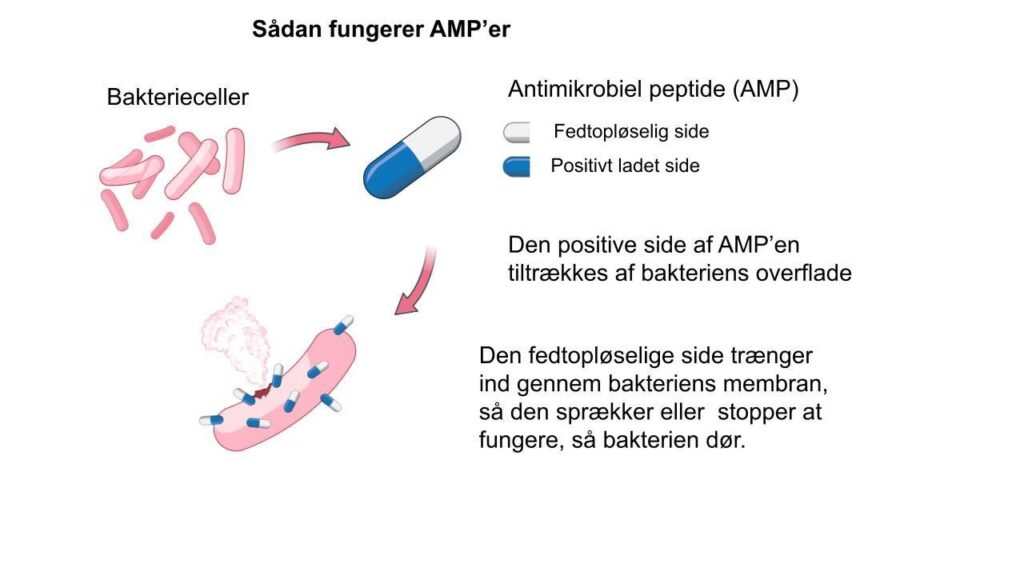
Svært at udvikle resistens mod AMP’er
Strukturelt har alle AMP’er en side med positiv ladning og en modsat side med fedtopløselige aminosyrer. Den positive ladning gør det muligt at interagere med bakteriens negative overflade, og dernæst kan de fedtopløselige aminosyrer trænge ind i bakteriens cellemembran.
Det vil føre til destabilisering af membranen, sådan at bakterien ved høj koncentration af AMP vil dø. Ved lav koncentration kan peptiderne trænge videre ind i bakterien og forstyrre forskellige biologiske processer som for eksempel proteinsyntese og kopiering af DNA.
På den måde kan AMP’er dræbe bakterier og hæmme deres vækst på forskellige måder, noget der gør det yderst besværligt for bakterien at udvikle resistens mod AMP’er. Nogle forskere vil sågar sige, at det er umuligt for bakterien at udvikle resistens mod AMP’er.
Men det vil være smart at træde varsomt frem og måske udvikle molekyler, der ligner AMP’er, i stedet for blot at benytte klassiske AMP’er som fremtidig antibiotika. Hvis resistens over for kunstige AMP-antibiotika mod forventning kan opstå, vil det være meget problematisk, hvis disse AMP’er har for store lighedstræk med vores naturlige AMP’er.
Vi kan da befinde os i en situation, hvor vores nye medicin selekterer for krydsresistens, det vil sige resistens over for både den nye AMP-medicin, men også mod naturlige AMP’er, og dermed en bid af vores naturlige immunforsvar.
Fremtidens AMP-medicin
For at udvikle AMP-lignende medicin i fremtiden er det vigtigt at skabe en bedre forståelse af, hvad der gør, at AMP’er har så høj selektivitet for bakterielle membraner frem for vores egne celler?
Hvilke mekanismer ligger til grund for destabiliseringen af forskellige bakteriemembraner, og hvilke dele af AMP er vigtig for at øge selektiviteten yderligere?
Det er spørgsmål, vi forsøger at belyse i min forskningsgruppe. Vi har ved hjælp af kraftige lysmikroskoper været i stand til at studere, hvordan indholdet af bakteriecellerne strømmer ud gennem små porer i cellemembranen, efter vi udsætter bakterien for forskellige AMP’er.
Men i dag benytter vi også små vinkelspredningsteknikker og højfrekvent røntgen- og neutronstråler, fra enorme synkrotroner og spaltningsreaktorer rundt omkring i verden.
Med hjælp fra et supermikroskop
Ved brug af røntgen/neutroner får vi ikke dannet et direkte billede, ligesom ved brug af lys og mikroskopi. Men når partiklerne støder sammen med bakterien, der er behandlet med AMP’er, vil der skabes et spredningsmønster, akkurat som når man kaster en sten i vandet.
Forskellige AMP’er vil skabe forskellige skader i bakteriemembranen og resultere i forskellige spredningsmønstre. Ved hjælp af kompleks matematik og molekylemodeller vil man derfor kunne afkode spredningsmønsteret og danne et billede af, hvad der sker med bakterien på molekylært niveau.
Denne teknik er næsten som et supermikroskop. Håbet er, at det kan bidrage til forståelse og udvikling af medicin i fremtiden. Flere kunstige AMP’er er blevet undersøgt i kliniske studier, og nogle er kommet rigtig langt og har vist gode resultater (også i kliniske fase III-studier).
Der er ingen tvivl om, at AMP’er kan neutralisere multiresistente bakterier. Udfordringen ligger snarere i, at disse molekyler muligvis også har en række effekter på andre membransystemer, herunder vores egne raske celler.
For at kunne bruge AMP’er som medicin er der behov for bedre at forstå disse interaktioner. Hvor lang tid det vil tage er uklart, men når vi løber tør for antibiotika, der virker, vil tærsklen for at benytte kunstige AMP’er nok sænkes hurtigt.






